优信推送 | 微生物工程菌治疗领域动态

学术研究动态
搭载三型分泌系统的工程细菌可递送抗体药物预防结肠炎
#三型分泌系统 #Escherichia coli Nissle 1917 #炎症性肠病
2023年4月12日,麻省总医院和哈佛大学公共卫生学院的研究团队在 Cell Host&Microbe 期刊上发表文章:Engineered Escherichia coli for the in situ secretion of therapeutic nanobodies in the gut,该研究基于合成生物学的方法,开发出一套由大肠杆菌 Nissle 1917 构成的药物递送系统(PROT3EcT),可以直接向周围环境分泌蛋白质。该系统由三个模块组成:经过改造的志贺氏菌三型分泌系统模块,相关转录调控因子VirB表达模块以及治疗性纳米抗体表达模块。实验结果表明,工程菌 PROT3EcT 可在小鼠肠道内原位分泌药物并稳定定植,且不影响自身肠道菌群。在化学诱导的小鼠结肠炎模型中,使用单次预防剂量的 PROT3EcT 变体(分泌肿瘤坏死因子α(TNF-α)中和纳米抗体),足以降低促炎TNF水平并预防损伤和炎症的发生。另外,研究人员观察到 TNF-PROT3EcT 在抑制结肠炎发展方面与抗 TNF-α 单克隆抗体全身给药一样有效,这表明它有可能发挥类似的作用,即作为IBD患者的维持治疗。这些研究为 PROT3EcT 作为一种多功能治疗平台的持续发展奠定了基础。
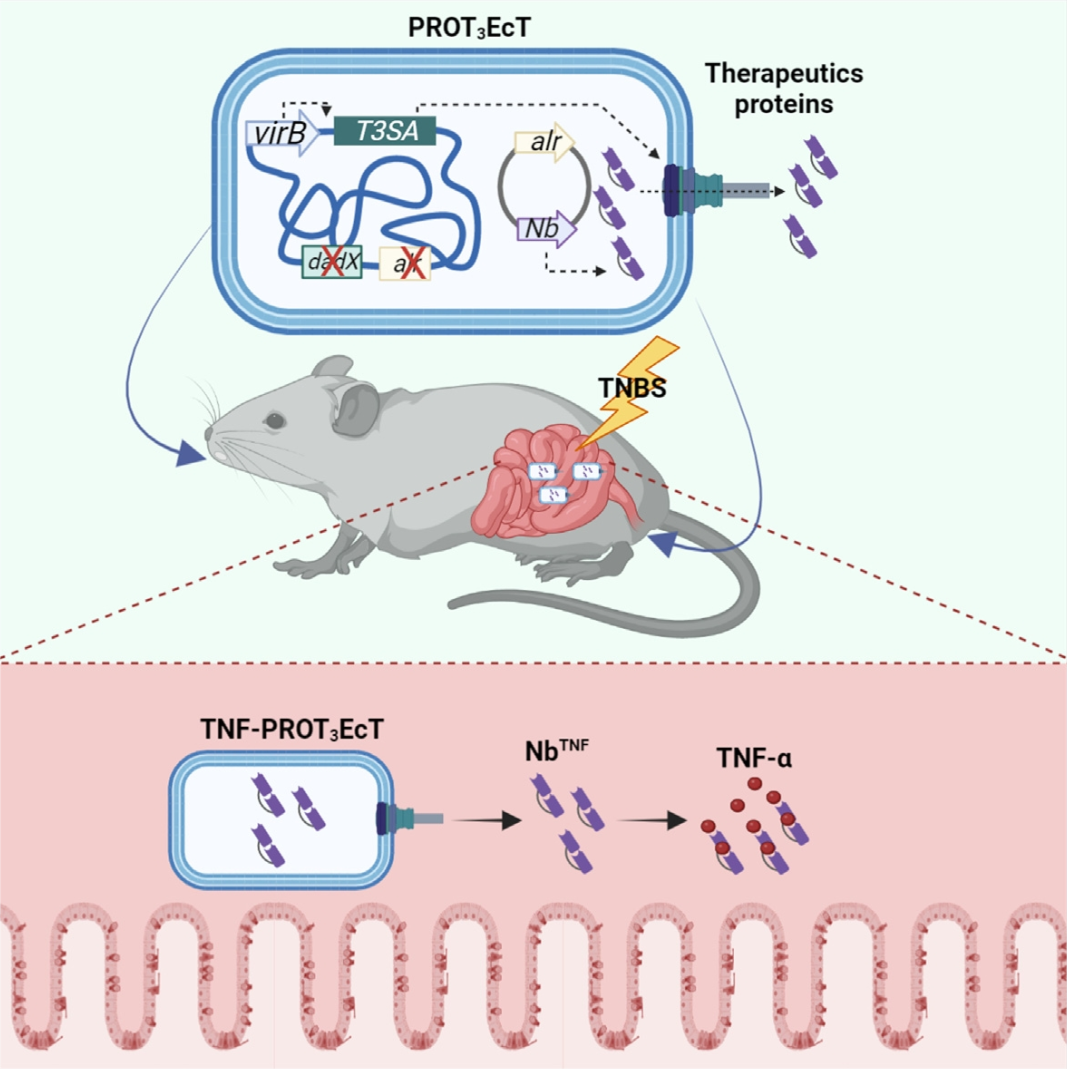
doi: 10.1016/j.chom.2023.03.007.
通过裂解回路控制的工程细菌可释放纳米疫苗抑制肿瘤生长
#基因线路 #细菌裂解调控 #肿瘤纳米疫苗
2023年5月,天津大学王汉杰和刘培源团队在 Biomaterials 期刊上发表文章:A programmable oral bacterial hydrogel for controllable production and release of nanovaccine for tumor immunotherapy,构建了一种可编程口服工程菌水凝胶,用于肠道原位生产和释放肿瘤纳米疫苗。由于胃肠道转运(GIT)过程中存在各种酶和胃部酸性pH,口服蛋白疫苗的生物活性大大降低,限制了其治疗效果。本研究通过将工程化改造大肠杆菌与海藻酸钠/壳聚糖水凝胶包裹,有效保护了工程菌在胃环境中的活性;同时,以细菌微室(BMC)为骨架,在其表面展示 AH1-A5 抗原,并通过群集感应裂解回路(SLC)控制细菌发生周期性震荡裂解,从而实现纳米疫苗(BMC-AH1-A5)的生产与释放。与BMC 表面展示相比,BMC-AH1-A5纳米疫苗可有效激活抗原提呈细胞,并进一步激活 CD4(+)T 和 CD8(+)T 细胞,从而杀伤肿瘤细胞;通过构建皮下肿瘤模型,工程菌在体内会生产并释放纳米疫苗,激活肠系膜淋巴结和脾脏免疫细胞,抑制皮下肿瘤生长,也对全身免疫的激活有一定效果。该研究为口服蛋白疫苗的生物医学应用提供了新思路。

doi: 10.1016/j.biomaterials.2023.122147
生物标记物响应的工程化智能活菌可诊断和改善小鼠炎症性肠病
#生物标记物 #工程菌 #肠道疾病
2023年2月8日,华东理工大学叶邦策团队在 Cell Host&Microbe 期刊上发表文章:Biomarker-responsive engineered probiotic diagnoses, record, and ameliorate inflammatory bowel disease in mice,开发了一株工程化智能益生菌 i-ROBOT,具有在体内同时执行诊断、记录和改善 IBD 的功能。i-ROBOT 集成了三个模块:荧光报告模块,碱基编辑记录模块和药物表达分泌模块。首先,通过感知肠道疾病相关生物分子如炎症标志物硫代硫酸盐,产生实时荧光信号反应疾病状态;随后,记录系统将疾病信息转化为基因组 DNA 上的单核苷酸突变,进一步导致报告基因的表达激活,通过 DNA 测序或颜色反应可读取炎症信息;此外,工程菌搭载了一套自调控的药物表达和分泌系统,可根据疾病标志物的水平释放相应浓度的治疗药物,该策略在有效改善疾病的同时不会引起用药过量的副作用,例如肠纤维化等。本研究通过精准设计和模块构建使“智能活菌”向着更具有靶向性、安全性的方向发展,加速其在临床的转化和应用。研究团队同时在 STAR Protocols 杂志发表论文:Protocol for engineering E. coli Nissle 1917 to diagnose, record, and ameliorate inflammatory bowel disease in mice,详细介绍了如何利用该工程菌诊断,记录以及改善小鼠炎症性肠病的实验方案。
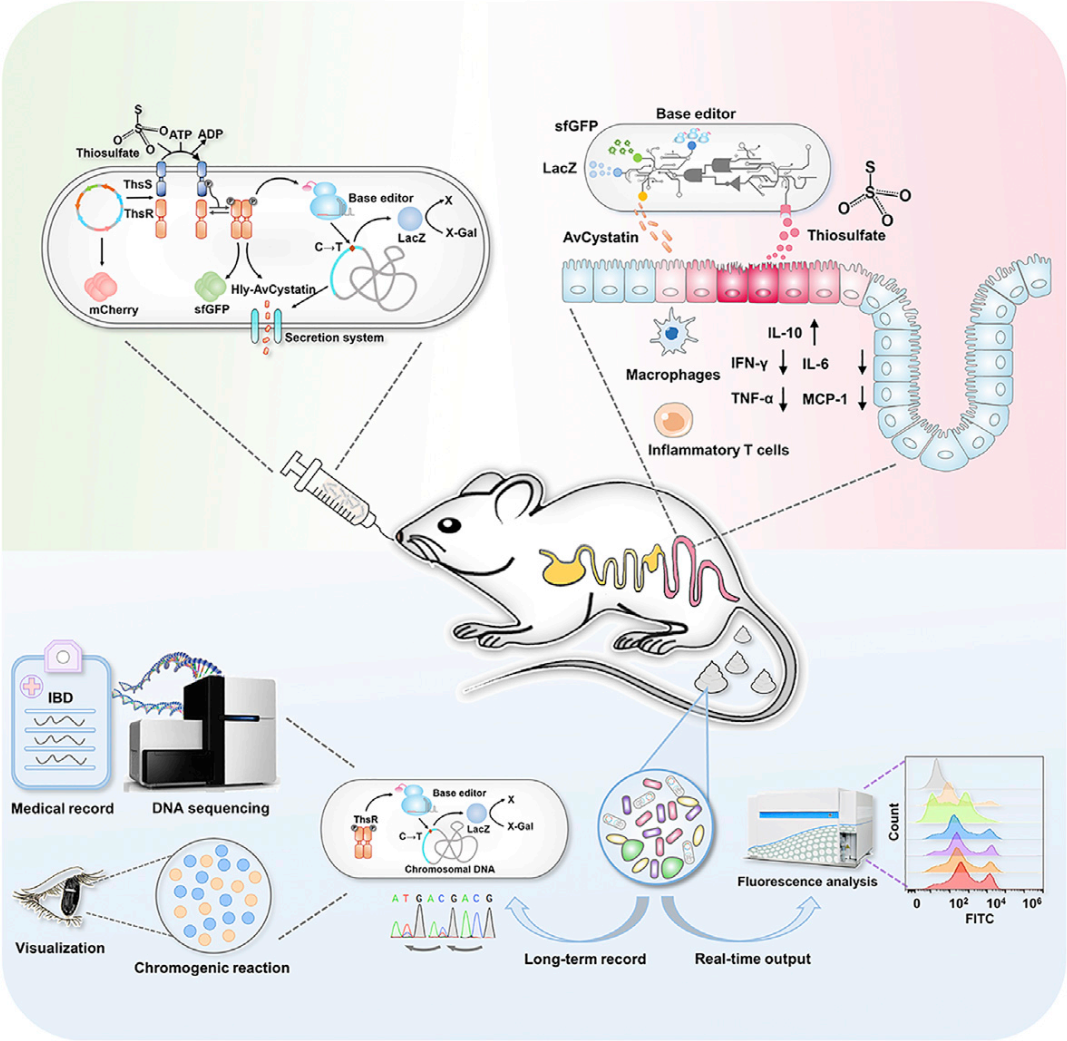
doi: 10.1016/j.chom.2022.12.004.
引入外源厌氧嘌呤降解途径的工程菌可有效缓解高尿酸血症
#厌氧嘌呤降解 #E. coli Nissle 1917 #高尿酸 #痛风
2023年5月,天津大学药学院张雁与合作团队在 Cell Chemical Biology 期刊上发表文章:Anaerobic purinolytic enzymes enable dietary purine clearance by engineered gut bacteria,报道了厌氧细菌中的嘌呤分解途径,并将其整合进益生菌 Nissle 1917 中,用于治疗痛风。研究人员首先解析出与嘌呤分解相关的四种水解酶(XnhABDE)和一种脱羧酶(XnhC),它们依次降解黄嘌呤形成亚氨甲基甘氨酸,亚胺甲基会转化为氨和甲酸,与 ATP 的形成偶联,甘氨酸则会通过还原酶、裂解酶等系统代谢。随后,将该嘌呤降解途径中的两种水解酶(XnhAB)引入大肠杆菌 Nissle 1917 中,以适应肠道厌氧环境;同时,为了促进嘌呤摄入和黄嘌呤形成,作者在黄嘌呤渗透酶、鸟嘌呤脱氨酶和鸟嘌呤/次黄嘌呤渗透酶基因的上游插入强组成型启动子gapA,以增强其表达。改造后的工程菌可在厌氧条件下以黄嘌呤为唯一碳源生长。通过构建高尿酸血症的果蝇模型,进一步证实口服该工程菌后可缓解高嘌呤饮食导致的肾尿酸结石和寿命缩短,为高尿酸血症和痛风治疗开发了一种新的策略。
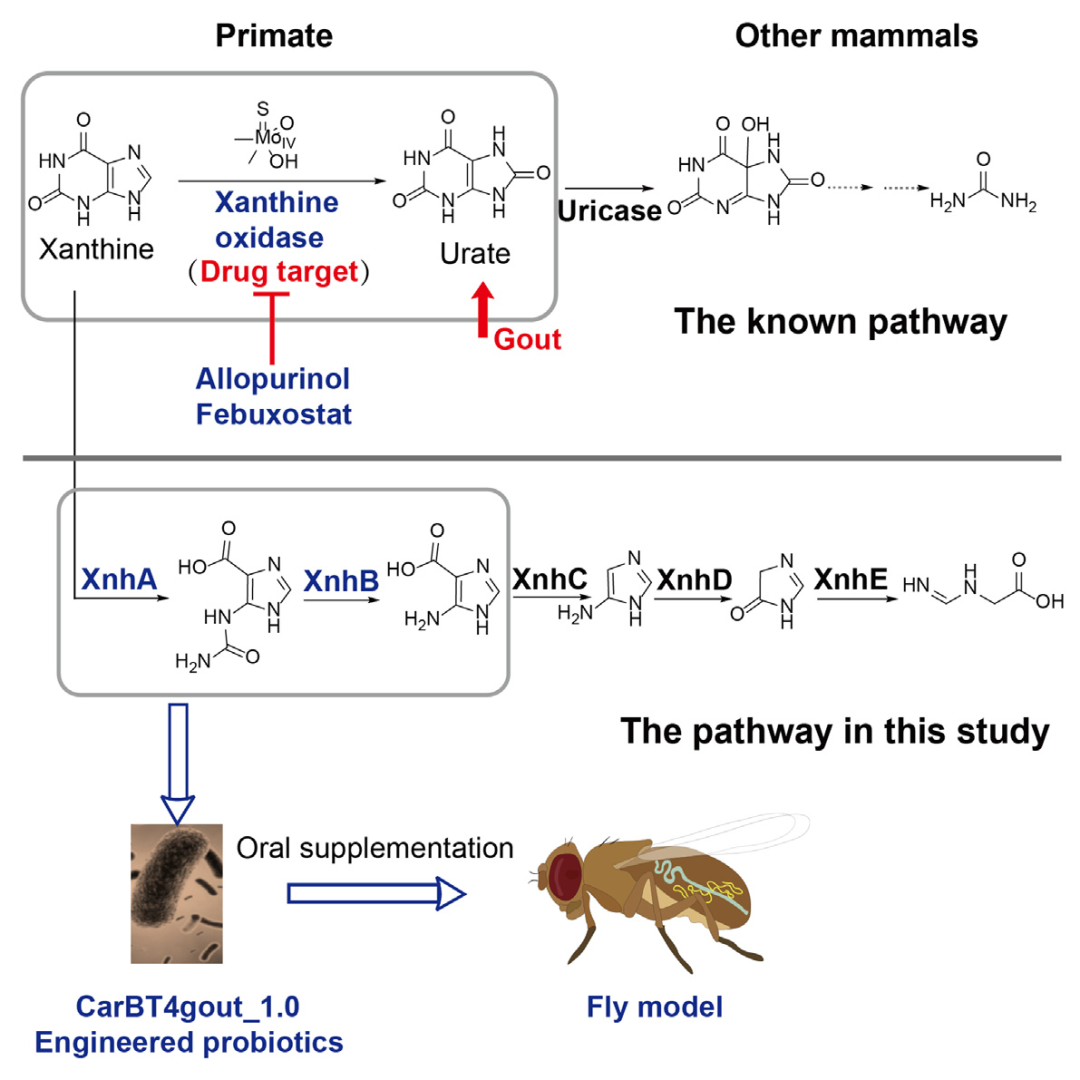
doi: 10.1016/j.chembiol.2023.04.008.
通过微生物共培养自组装活体胶囊以增强炎症小鼠治疗
#大肠杆菌 #木醋杆菌 #自组装 #活体胶囊
2023年5月9日,武汉大学张先正团队和赵发琼团队合作在 Nano Letters 期刊上发表文章:Autonomously Assembled Living Capsules by Microbial Coculture for Enhanced Bacteriotherapy of Inflammatory Bowel Disease,通过在含益生元的发酵液中将益生菌(EcN)与木醋杆菌(G. xylinus)共培养,构建了益生元-益生菌活体胶囊(PPLC)。由于晃动会使得 G. xylinus 分泌纤维素原纤维,在剪切力的作用下,纤维素原纤维可以自发包封 EcN 形成胶囊。此外,存在于发酵液中的益生元也能够通过范德华力和氢键结合到细菌纤维素网络中。随后,将微胶囊转移到选择性 LB 培养基中,以促进在微胶囊中形成密集的益生菌菌落。体内研究表明,含有密集 EcN 菌落的 PPLC 能够在肠炎小鼠体内表现出对抗肠道病原菌和恢复微生物群稳态的作用,具有良好的治疗效果。该研究构建的益生菌和益生元生物材料的原位自组装策略能够为治疗炎症性肠病提供一个新的有效途径。
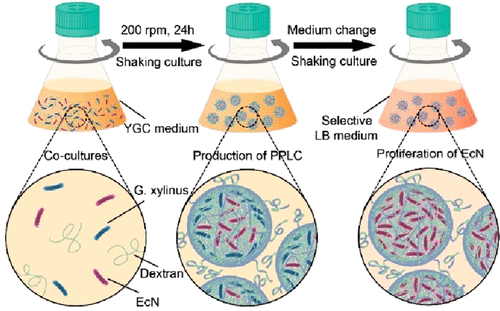
doi.org/10.1021/acs.nanolett.3c00657
临床研究动态
近日,一款治疗伤口愈合的基因工程菌 ILP-100 的第一个随机对照试验结果发表(doi: 10.1073/pnas.1716580115)。ILP-100-外用剂型由一家瑞典的生物科技公司Ilya Pharma研发,是由一种非人类来源的罗伊氏乳杆菌 R2LC (L. reuteri R2LC)经基因工程设计改造而来,将该菌局部使用后,伤口内乳酸杆菌原位产生并递送 CXCL12-α, 乳酸杆菌产生的乳酸局部降低pH。通过局部 pH 降低使 CXCL12-α 降解酶 CD26 失活,增加了CXCL12-α 的生物利用度。使得 CXCR4+ 巨噬细胞的积累并促使巨噬细胞的 TGF-β 产生增加以及真皮细胞的增殖,从而促进伤口愈合过程。
目前,ILP-100-外用治疗糖尿病足的2期临床试验在瑞典两家中心入组中,而治疗外科伤口的临床试验已经获得IND批准,即将开始入组。另外,据公司官网消息,ILP-100口服剂型也即将准备递交IND中,目标适应症为免疫节点抑制剂诱发的免疫相关性结肠炎。

https://www.ilyapharma.se/
U-SynBio(优信合生) 由中国农业大学及顶级研究所的年轻生物学家创建, U-SynBio创业团队,掌握国内一流的生物技术,在合成生物学领域处于前列位置。
U-SynBio采用合成生物学技术,创建的活体生物药技术平台,初获成功,现处于产业化进程中。
满怀创新与创业的梦想,致力于中国LBP的探索,努力成为中国LBP行业的头部企业,是U-SynBio的愿景。

关注我们
微信号|U-Synbio
主页|http://www.usynbio.com/
1
END
1
